 Ảnh minh họa: Tóm tắt công thức Hóa học lớp 12 cả năm
Ảnh minh họa: Tóm tắt công thức Hóa học lớp 12 cả năm
Hóa học lớp 12 là một môn học quan trọng và cần thiết cho các em học sinh trong quá trình học tập. Để giúp các em dễ dàng nhớ kiến thức và công thức, VietJack đã biên soạn bản Tóm tắt công thức Hóa học lớp 12 cả năm chi tiết. Với loạt bài này, hy vọng sẽ như một cuốn sổ tay kiến thức và công thức giúp bạn học tốt môn Hóa học lớp 12.
Tóm tắt công thức Hóa học lớp 12 Chương 1, 2, 3, 4
CHƯƠNG I: ESTE - LIPIT
- Công thức tổng quát của este no, đơn chức, hở: CnH2nO2 (n ≥ 2)
- Tính số đồng phân este đơn chức no: Số đồng phân este CnH2nO2 = 2n-2 (điều kiện: 1 < n < 5)
- Tính số triglixerit tạo bởi gilxerol với các axit cacboxylic béo: Số trieste = ...
CHƯƠNG II: CACBOHIĐRAT
- Công thức chung của cacbohiđrat: Cn(H2O)m
- Công thức cụ thể của một số cacbohiđrat, như tinh bột, glucozơ, saccarozơ.
CHƯƠNG III: AMIN, AMINO AXIT VÀ PROTEIN
- Công thức tổng quát amin no, đơn chức, hở: CnH2n+1NH2 (n ≥ 1)
- Tính số đồng phân amin đơn chức no: Số đồng phân amin CnH2n+1NH2 = 2n -1 (điều kiện: n < 5)
- Tính số peptit tối đa tạo bởi hỗn hợp gồm x amino axit khác nhau.
CHƯƠNG IV: POLIME VÀ VẬT LIỆU POLIME
Công thức tính hệ số trùng hợp polime.
Tóm tắt công thức Hóa học lớp 12 Chương 5
- Dãy hoạt động hóa học của kim loại.
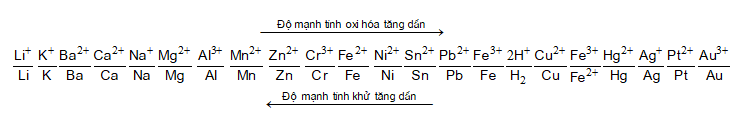
- Quy tắc alpha ().
- Giả sử có hai cặp oxi hóa khử: Xx+/ X và Yy+/Y (trong đó cặp Xx+/ X đứng trước cặp Yy+/Y trong dãy điện hóa).
- Áp dụng quy tắc alpha (), phản ứng xảy ra theo chiều mũi tên như sau:
- Công thức biểu diễn định luật Faraday.
Tóm tắt công thức Hóa học lớp 12 Chương 6
- Tính lượng kết tủa xuất hiện khi hấp thụ hết lượng CO2 vào dd Ca(OH)2 hoặc Ba(OH)2.
- Tính lượng kết tủa xuất hiện khi hấp thụ hết lượng CO2 vào dd chứa hỗn hợp NaOH và Ca(OH)2 hoặc Ba(OH)2.
- Tính VCO2 cần hấp thụ hết vào dd Ca(OH)2 hoặc Ba(OH)2 thu được lượng kết tủa theo yêu cầu.
- Tính Vdd NaOH cần cho vào dd Al3+ để xuất hiện lượng kết tủa theo yêu cầu.
- Tính Vdd HCl cần cho vào dd Na[Al(OH)]4 (hoặc NaAlO2) để xuất hiện lượng kết tủa theo yêu cầu.
Tóm tắt công thức Hóa học lớp 12 Chương 7
- Tính khối lượng muối sunfat thu được khi hoà tan hết hỗn hợp kim loại bằng H2SO4 loãng.
- Tính khối lượng muối clorua thu được khi hoà tan hết hỗn hợp kim loại bằng dd HCl.
- Tính khối lượng muối sunfat thu được khi hoà tan hết hỗn hợp oxit kim loại bằng H2SO4 loãng.
- Tính khối lượng muối clorua thu được khi hoà tan hết hỗn hợp oxit kim loại bằng dd HCl.
- Tính khối lượng muối clorua thu được khi hoà tan hết hỗn hợp kim loại bằng dd HCl vừa đủ.
- Tính khối lượng muối sunfat thu được khi hoà tan hết hỗn hợp các kim loại bằng H2SO4 đặc, nóng.
- Tính khối lượng muối sunfat thu được khi hoà tan hết hỗn hợp các kim loại bằng H2SO4 đặc, nóng, dư.
- Tính số mol HNO3 cần dùng để hòa tan hỗn hợp các kim loại.
- Tính số mol H2 SO4 đặc, nóng cần dùng để hoà tan 1 hỗn hợp kim loại.
- Tính khối lượng muối nitrat kim loại thu được khi cho hỗn hợp các kim loại tác dụng HNO3.
- Tính khối lượng muối thu được khi cho hỗn hợp sắt và các oxit sắt tác dụng với HNO3.
- Tính khối lượng muối thu được khi hoà tan hết hỗn hợp gồm Fe, FeO, Fe2O3, Fe3O4 bằng HNO3 đặc, nóng.
- Tính khối lượng muối thu được khi hoà tan hết hỗn hợp gồm Fe, FeO, Fe2O3, Fe3O4 bằng H2SO4 đặc, nóng, dư.
- Tính khối lượng sắt đã dùng ban đầu, biết oxi hoá lượng sắt này bằng oxi được hỗn hợp rắn X.
- Tính khối lượng sắt đã dùng ban đầu, biết oxi hoá lượng sắt này bằng oxi được hỗn hợp rắn X.
- Tính VNO (hoặc NO2) thu được khi cho hỗn hợp sản phẩm sau phản ứng nhiệt nhôm tác dụng với HNO3.
- Tính m gam Fe3O4 khi dẫn khí CO qua, nung nóng một thời gian, rồi hoà tan hết hỗn hợp rắn sau phản ứng bằng HNO3 loãng dư được khí NO là duy nhất.
- Tính m gam Fe3O4 khi dẫn khí CO qua, nung nóng một thời gian, rồi hoà tan hết hỗn hợp rắn sau phản ứng bằng H2SO4 đặc, nóng, dư được khí SO2 là duy nhất.
Đó là tổng quan về tóm tắt công thức Hóa học lớp 12. Hy vọng với tài liệu này, các em học sinh sẽ dễ dàng nhớ và áp dụng công thức vào việc giải các bài tập Hóa học lớp 12. Ngoài ra, bạn cũng có thể tìm hiểu thêm các tóm tắt công thức Hóa học của các lớp khác nhau để nắm vững kiến thức.
Săn SALE shopee Tết:
- Đồ dùng học tập giá rẻ
- Sữa dưỡng thể Vaseline chỉ hơn 40k/chai
- Tsubaki 199k/3 chai
- L'Oreal mua 1 tặng 3
















