 Axit sunfuric - tổng quan
Axit sunfuric - tổng quan
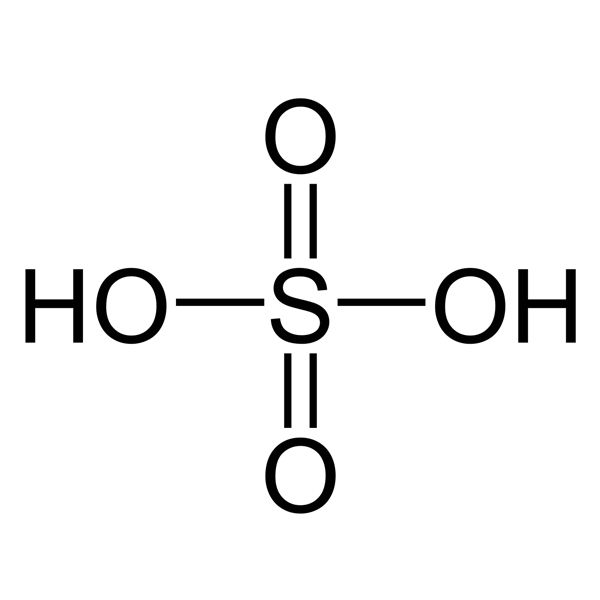
Axit sunfuric, có công thức hóa học H2SO4, là một chất lỏng không màu và không mùi. Đây là một chất quen thuộc trong chương trình hóa học lớp 10. Trong bài viết này, chúng ta sẽ tìm hiểu về tính chất vật lý và tính chất hóa học của axit sunfuric, cùng với cách điều chế và ứng dụng của nó trong cuộc sống.
Tính chất vật lý của axit sunfuric
Axit sunfuric là một chất lỏng có khối lượng riêng là 1,84 g/cm3, nhiệt độ nóng chảy là 10°C và nhiệt độ sôi là 338 °C. Nó là một chất lỏng tan vô hạn trong nước và có đặc tính háo nước, tỏa nhiều nhiệt. Do đó, khi pha loãng axit sunfuric đặc, ta phải cho từ từ axit vào nước để tránh nguy cơ bỏng nặng. Ngoài ra, axit sunfuric còn có khả năng hút nước, làm than hóa các hợp chất hữu cơ.
Tính chất hóa học của axit sunfuric
Axit sunfuric loãng (H2SO4 loãng)
Axit sunfuric loãng là một axit mạnh, có đầy đủ các tính chất hóa học chung của một axit. Nó có khả năng làm quỳ tím chuyển thành màu đỏ do tính axit mạnh. Axit sunfuric loãng cũng có khả năng tác dụng với các kim loại trong dãy hoạt động hóa học của kim loại. Ví dụ, axit sunfuric tác dụng với sắt theo phản ứng:
Fe + H2SO4 → FeSO4 + H2↑
Axit sunfuric loãng cũng có thể tác dụng với bazơ và oxit bazơ để tạo ra muối và nước. Ví dụ:
2NaOH + H2SO4 → Na2SO4 + 2H2O
Axit sunfuric đặc (H2SO4 đặc)
Axit sunfuric đặc là một axit mạnh và có tính háo nước. Nó cũng tác dụng với các kim loại, tạo ra muối và các sản phẩm oxi hóa khác nhau như SO2, H2S, S. Ví dụ:
2Al + H2SO4 đặc nóng → Al2(SO4)3 + 3SO2 + 6H2O
Axit sunfuric đặc cũng tác dụng với phi kim và các chất khử khác. Ví dụ:
C + 2H2SO4 đặc nóng → CO2 + 2SO2 + 2H2O
H2SO4 đặc nóng + 8HI → H2S + 4I2 + 4H2O
Điều chế axit sunfuric
Axit sunfuric được sản xuất trong công nghiệp từ lưu huỳnh, oxi và nước. Có hai phương pháp chính để điều chế axit sunfuric: phương pháp tiếp xúc và phương pháp từ quặng pirit sắt.
Trong phương pháp tiếp xúc, lưu huỳnh được đốt để tạo ra SO2. Sau đó, SO2 được ôxi hóa bởi oxi và chất xúc tác ôxít vanadi (V2O5) để tạo thành lưu huỳnh trioxit (SO3). Cuối cùng, lưu huỳnh trioxit được hòa tan bằng nước để tạo ra axit sunfuric.
Ngoài ra, SO3 có thể bị hấp thụ bởi axit sunfuric để tạo ra ôleum (H2SO4.xSO3), sau đó ôleum được pha loãng để tạo ra dung dịch axit sunfuric.
Ứng dụng của axit sunfuric
Axit sunfuric có rất nhiều ứng dụng trong công nghiệp. Nó được sử dụng làm nguyên liệu chính hoặc chất xúc tác trong nhiều quá trình sản xuất, bao gồm:
- Điều chế các axit và muối sunfat khác.
- Tẩy rửa kim loại trước khi mạ hoặc sơn màu.
- Sản xuất tơ sợi hóa học.
- Chế tạo thuốc nổ, chất dẻo, thuốc nhuộm, dược phẩm và chất giặt tẩy rửa tổng hợp.
- Sản xuất ắc quy.
- Xử lý nước thải và sản xuất phân bón.
Axit sunfuric có vai trò quan trọng trong nhiều lĩnh vực và là một trong những hóa chất hàng đầu được sử dụng trong công nghiệp.
Với bài viết này, chúng ta đã tìm hiểu về tính chất hóa học của axit sunfuric cùng với những ứng dụng quan trọng của nó. Hãy nắm vững kiến thức này và áp dụng vào việc học và giải các bài tập liên quan đến axit sunfuric.















